NH4OH là gì? Tính chất vật lý, hóa học của NH4OH ra sao? Cách ứng dụng và điều chế NH4OH như thế nào? Đó là một số câu hỏi điển hình nhất về hóa chất NH4OH mà chúng tôi nhận được trong thời gian vừa qua. Để giúp bạn đọc hiểu rõ hơn về hóa chất này và biết cách sử dụng nó an toàn, chúng tôi đã tổng hợp lại những thông tin liên quan để NH4OH trong bài viết dưới đây.
NH4OH là gì?
NH4OH hay còn gọi là amoni hydroxit, amoniac nước hay dung dịch amoniac là một dung dịch amoniac lỏng trong nước. Hiểu một cách đơn giản thì NH4OH được tạo ra khi cho amoniac (NH3) tương tác với nước và tồn tại ở trạng thái lỏng.
Trong tự nhiên, NH4OH được tạo ra từ quá trình phân hủy xác động vật, vi sinh vật hoặc quá trình bài tiết của động vật.
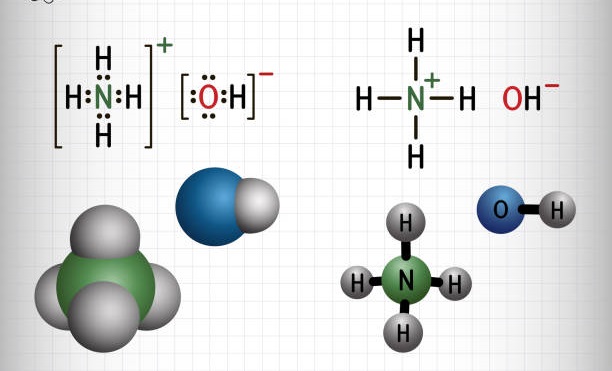
NH4OH là gì
Tính chất của NH4OH Amoni Hydroxit là gì?
Cũng như các chất hóa học khác, amoni hydroxit NH4OH có những tính chất vật lý, hóa học đặc trưng. Cụ thể thì NH4OH có những tính chất sau:
Tính chất vật lý của NH4OH
NH4OH là một dung dịch không màu, tan tốt trong nước, bay mùi mạnh và có mùi khai đặc trưng của ammoniac. Khi ngửi nhiều có thể bị ngộ độc. Mặc dù tồn tại ở trạng thái dung dịch nhưng nó vẫn mang những tính chất đặc trưng của NH3.
- Khối lượng mol của NH4OH: 35.04 g/mol.
- Độ pH: Là một dung dịch có tính kiềm yếu với pH≈12.
- Khối lượng riêng: 88g/cm3 (35% w/w) và 91g/cm3 (25% w/w).
- Điểm sôi: 37.7 độ C (310.8K; 99.9 độ F) (25 %w/w).
- Điểm tan chảy: -57.7 độ C (25% w/w); -91.5 độ C (35% w/w).
- Điểm đóng băng: -77.7 độ C (tinh thể màu trắng).
Tính chất hóa học của NH4OH
– Làm đổi màu chất thử
Mặc dù là một bazo yếu nhưng NH4OH lại có khả năng phản ứng với nhiều chất và có thể làm cho quỳ tím chuyển sang màu xanh hoặc làm cho dung dịch phenolphtalein chuyển sang màu hồng. Chính vì vậy mà quỳ tím thường được dùng để phát hiện ra amoniac.

NH4OH làm cho quỳ tím chuyển sang màu xanh
– Dễ bị phân hủy
Amoni hydroxit dễ bị phân hủy trong dung dịch và giải phóng ra khí amoniac với phương trình ion rút gọn là:
NH4+ + OH– → NH3 + H2O
Hoặc phương trình điện ly là:
NH3 + H2O ⇆ NH4+ + OH– ⇆ NH4+ + OH−
– Phản ứng với axit
Dù tồn tại ở dạng khí hay ở dung dịch thì NH4OH đều có thể dễ dàng trung hòa axit tạo thành muối amoni.
2NH3 + H2SO4 → (NH4)SO4
NH3 + H+ → NH4+
– Phản ứng với dung dịch muối
Dung dịch ammoniac tác dụng với muối và tạo thành hidroxit kim loại, ví dụ như cho dung dịch ammoniac tác dụng với dung dịch đồng (II) sunfat sẽ tạo ra kết tủa xanh lam.
NH3 + CuSO4 + H2O → (NH4)2SO4 + Cu(OH)2↓
– Tạo phức
NH4OH có khả năng tạo phức với nhiều hợp chất khó tan của kim loại như Ag, Cu, Ni,…
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 ( dung dịch có màu xanh thẫm)
Cách điều chế NH4OH như thế nào?

Cách điều chế NH4OH
Tùy vào yêu cầu sản xuất như số lượng, độ tinh khiết,…. mà chúng ta có thể điều chế NH4OH trong phòng thí nghiệm hoặc trong công nghiệp bằng một trong những phương pháp sau đây:
Trong phòng thí nghiệm
Khí NH3 thường được thu hồi bằng cách cho muối amoni phản ứng với dung dịch kiềm theo phương trình sau:
2NH4Cl + Ca(OH)2 → NH3 + CaCl2 + H2O
Trong công nghiệp
Dung dịch NH4OH được điều chế bằng cách hòa tan khí amoniac NH3 vào nước theo tỷ lệ yêu cầu. Phần lớn khí NH3 (90%) được thu hồi và sản xuất theo phương thức Haber – Bosch, trong đó khí nito được thu hồi từ metan và nước.
Khi thực hiện phản ứng cần có các điều kiện phù hợp để chuyển dịch cân bằng về phía bên phải (theo nguyên lý Le Chatelier) bởi phản ứng trên xảy ra thuận nghịch và tỏa nhiệt. Phản ứng này thường xảy ra ở nhiệt độ 450 – 500 độ C, áp suất 200 – 300 atm với chất xúc tác là hỗn hợp sắt, nhôm oxit,… Tuy nhiên hiệu suất của phản ứng chỉ đạt 20 – 25%.
Phản ứng xảy ra theo phương thức CaCN2 của Rothe-Frank-Caro: CaCN2 + 3H2O → CaCO3 + 2NH3
Phản ứng theo phương thức Persek: 2AIN + 3H2O → Al2O3 + 2NH3
Phản ứng NO và H2: 2NO + 5H2 → 2NH3 + 2H2O
Ứng dụng của NH4OH trong công nghiệp và đời sống
NH4OH có vai trò đặc biệt quan trọng, đặc biệt là trong các ngành công nghiệp:
- Là nguyên liệu chính cung cấp nito cho ngành công nghiệp sản xuất phân bón, hóa dược, hóa chất,….
- Dung dịch NH4OH là tiền chất chất để điều chế các alkyl amine.
- Ứng dụng trong lĩnh vực xử lý nước thải công nghiệp, sinh hoạt.

Dùng NH4OH trong xử lý nước thải
- Đóng vai trò như một công chất làm lạnh dùng trong nhiều ngành công nghiệp.
- Trong ngành chế tạo cao su, NH4OH được dùng để tạo ra môi trường chống đông giúp bảo quản mủ cao su và được sử dụng làm chất xúc tác.
- Dung dịch ammonia nồng độ 1 – 3% là một thành phần của chất tẩy rửa, giúp làm sạch các vật dụng trong gia đình và làm sạch thép không rỉ, sứ.
- Dùng để sản xuất hidrazin N2H4 làm nhiên liệu cho tên lửa.
- Trong công nghệ làm lạnh, amoni hydroxit được sử dụng để khử khí NOx, điều chỉnh nồng độ pH trong lò hơi.
- Dùng trong nghệ thuật và thủ công mỹ nghệ với vai trò là làm tối hoặc nhuộm màu gỗ.
- Trong công nghiệp sản xuất thực phẩm, amoni hydroxit được ứng dụng trong làm bánh hoặc làm chất giúp điều chỉnh độ chua cho thực phẩm.
- Ngoài ra, amoni hydroxit còn được dùng trong ngành dệt may, ngành keo, sản xuất tơ, xử lý rơm rác cho gia súc,…
Hướng dẫn cách xử lý sự cố liên quan đến NH4OH
NH4OH là một chất độc với tính ăn mòn mạnh.
– Khi tiếp xúc với mắt, nó có thể gây dị ứng, bỏng hoặc dẫn tới mù lòa. Nếu để hóa chất bắn vào mắt, cần rửa mắt với nước lạnh tối thiểu 15 phút. Nếu đang đeo kính áp tròng thì phải tháo ra ngay lập tức. Lưu ý là phải luôn giữ mí mắt mở rộng trong suốt quá trình rửa. Sau khi rửa xong, hãy đưa nạn nhân đến cơ sở y tế gần nhất để kiểm tra, thăm khám và có hướng điều trị phù hợp.
– Hít phải hơi amoni hydroxit tùy vào nồng độ mà có thể gây hắt hơi, sổ mũi, ngạt mũi, thậm chí phù phổi và tử vong. Liều gây chết của NH4OH là khoảng 5000ppm. Khi nạn nhân bị ngạt hơi NH4OH, cần di chuyển nạn nhân đến nơi thoáng khí. Nếu nạn nhân không thể tự hồi phục được thì cần đưa nạn nhân đến cơ sở y tế gần nhất để xử lý. Trong quá trình di chuyển, hãy giữ nạn nhân ở tư thế thuận lợi cho việc hô hấp.
– Nuốt phải NH4OH có thể gây bỏng thực quản, dạ dày,… và xuất hiện các triệu chứng buồn nôn, đau ngực. Liều gây tử vong của NH4OH là 3-4ml. Trường hợp này rất nguy hiểm và chúng ta cần phải đưa nạn nhân đến cơ sở y tế gần đó để kiểm tra, điều trị.
– NH4OH có thể gây bỏng da khi tiếp xúc. Nếu để hóa chất bắn lên da, cần cởi bỏ ngay quần áo bị dị dính hóa chất và dùng nước để rửa sạch (rửa khoảng 15 phút). Sau đó đưa nạn nhân đến cơ sở y tế gần nhất để kiểm tra nếu da bị sưng đau, phồng rộp,….
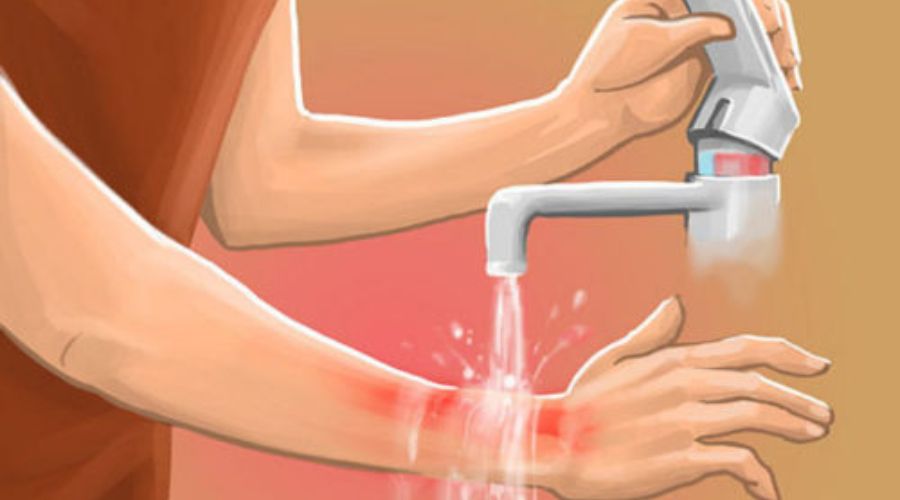
NH4OH có thể gây bỏng da khi tiếp xúc
Lưu ý khi sử dụng và bảo quản NH4OH
Cách sử dụng
Tùy vào mục đích sử dụng mà NH4OH có thể được dùng theo các cách khác nhau. Người dùng cần phải đọc kỹ các thông số an toàn và hướng dẫn sử dụng để đảm bảo độ an toàn khi dùng hóa chất. Trong quá trình làm việc với hóa chất, người lao động cần mang đồ bảo hộ chuyên dụng và chỉ nên thực hiện ở nơi thông thoáng khí, tránh nơi ẩm ướt và tránh xa các nguồn nhiệt.
Cách bảo quản
– Nơi bảo quản hóa chất phải thoáng mát, khô ráo, tránh nơi có nhiệt độ cao và tránh nơi có ánh nắng trực tiếp chiếu vào.
– Không để chung hoặc để gần các hóa chất khác.
– Đậy kín sản phẩm sau khi mở và phải có thùng chứa chuyên dụng để bảo quản NH4OH.
Với những thông tin vừa nêu trên, các bạn chắc hẳn đã hiểu rõ về NH4OH là gì rồi đúng không nào. Để được bổ sung thêm nhiều kiến thức về hóa chất hơn nữa, các bạn hãy thường xuyên truy cập vào website https://dongachem.vn/ của Hóa Chất các bạn nhé.
