Axit HCl đặc được sử dụng phổ biến và có tính ứng dụng cao đối với cuộc sống và sản xuất công nghiệp. Tuy nhiên đây là một axit mạnh và độc hại, nắm rõ các phản ứng điển hình của HCl sẽ giúp bạn vận dụng vào nghiên cứu, học tập và sản xuất một cách hiệu quả nhất.
1. HCl đặc có nồng độ là bao nhiêu?
Nồng độ axit HCl đậm đặc nhất là 32% – 40%, nó được sử dụng phổ biến trong ngành công nghiệp luyện kim, sản xuất cao su, chế biến thực phẩm hay trong ngành công nghiệp xi mạ. Không những vậy, axit HCl đặc còn được sử dụng để xử lý nước, giảm độ pH trong nước…
Đối với các loại hóa chất HCl đặc, khi sử dụng cần tuân thủ các nguyên tắc sau:
-
Chứa axit HCl trong các vật liệu kháng axit như composite, PVC, đảm bảo có nắp đậy kín và chắc chắn.
-
Mang đầy đủ đồ bảo hộ an toàn hóa chất: Gang tay, khẩu trang, quần áo, mặt nạ phòng độc, kính mắt.
-
Khi bị axit HCl đặc bắn vào mắt, vào da cần nhanh chóng rửa sạch với nước và đến cơ sở y tế gần nhất.
-
Sử dụng axit đúng liều lượng, không quá nhiều cũng không quá ít. Có thể trung hòa axit bằng dung dịch Bazơ.

HCl đặc có nồng độ là bao nhiêu?
2. Một số phản ứng điển hình của axit HCl đặc
Axit HCl đặc mang đầy đủ tính chất của một axit mạnh, làm quỳ tím đổi sang màu đỏ và các phản ứng sau đây.
2.1. Fe + HCl đặc nóng
Sắt ̣Fe là kim loại được sử dụng phổ biến trong cuộc sống hàng ngày, khi sắt tác dụng với axit HCl đặc nóng sẽ xảy ra phản ứng sau:
Fe + 2HCl → FeCl3 + H2↑
Về cơ bản, sắt khi tác dụng với axit HCl đặc nóng sẽ bị oxi hoá lên mức +3 và tạo muối FeCl3. Điều kiện xảy ra phản ứng ở nhiệt độ cao.
2.2. Fe + HCl đặc nguội
Fe khi được kết hợp với axit đặc nguội, không có sự tác động của nhiệt độ sẽ xảy ra phản ứng sau:
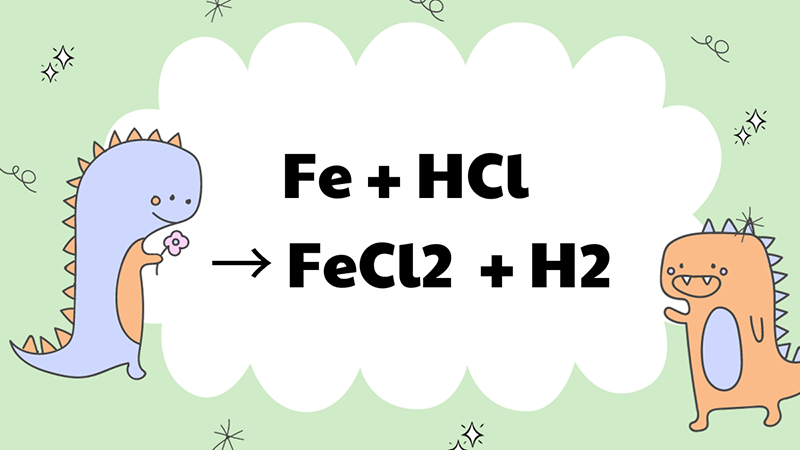
Fe + 2HCl → FeCl2 + H2↑
Trong trường hợp này, sắt tác dụng với HCl đặc nguội sẽ bị oxi hoá lên mức +2 và tạo thành muối FeCl2. Phản ứng này được sử dụng phổ biến trong sản xuất công nghiệp và thường thấy trong các bài thi hoá học.
2.3. Axit HCl đặc + KMnO4
Khi ta cho vào ống nghiệm vài tinh thể KMnO4 sau đó nhỏ tiếp vào giọt dung dịch HCl đậm đặc và đậy kín ống nghiệm bằng nút cao su ta sẽ thu được phương trình phản ứng sau:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Hiện tượng có khí màu vàng lục bay ra từ ống nghiệm đó chính là khí Clo. Phản ứng này thường được sử dụng trong nhiều lĩnh vực như: Sản xuất nước tẩy trắng, tẩy vải, sản xuất clo công nghiệp, sử dụng để xử lý nước, loại bỏ hoàn toàn các chất vô cơ và hữu cơ.
2.4. HCl + MnO2 (điều kiện axit đặc)
Phản ứng HCl + MnO2 (điều kiện axit đặc) được sử dụng trong phòng thí nghiệm để điều chế Clo. Phương trình phản ứng được diễn ra như sau:
MnO2 + HCl → MnCl2 + Cl2 + H2O
Khi phản ứng xảy ra, chất rắn màu đen Mangan oxit sẽ tan dần và xuất hiện khí màu vàng lục Clo cùng với hiện tượng sủi bọt khí.
2.5. HCl + KClO3 (điều kiện axit đặc)
Khi axit HCl đặc tác dụng với KClO3 sẽ xảy ra phản ứng hoá học, sản phẩm thu được là clo và muối Kali clorua và nước. Phản ứng được sử dụng để điều chế khí Clo trong phòng thí nghiệm cũng như trong sản xuất hoá chất công nghiệp với điều kiện 25 độ C.
KClO3 + 6HCl → 3Cl2 + KCl + 3H2O
2.6. HCl + NH3 (điều kiện axit đặc)
Trong phòng thí nghiệm, khi cho 2 đũa thuỷ tinh có bông tẩm hóa chất NH3 đặc và axit HCl đặc ở gần nhau sẽ xảy ra phản ứng sau:
NH3 + HCl → NH4Cl
Đây là hai loại hóa chất dễ bay hơi nên chúng dễ dàng hòa hợp với nhau để tạo thành tinh thể muối amoni clorua và có hiện tượng khói trắng sau khi phản ứng xảy ra.
Phản ứng của sắt với axit clo hydric đặc
3. Cách pha loãng axit HCl đặc với nước
Axit HCl đặc cực kỳ nguy hiểm, nó có thể gây bỏng da thậm chí nguy hiểm đến tính mạng nếu không biết cách pha chế và sử dụng. Dưới đây là các bước pha loãng axit các chuyên gia sử dụng, bạn đọc tuyệt đối không tự ý pha chế tại nhà.
-
Bước 1: Người pha chế mặc quần áo bảo hộ an toàn, đeo găng tay, đeo khẩu trang, đeo kính mắt và đi ủng để đảm bảo đúng quy định an toàn hóa chất.
-
Bước 2: Lấy bình đựng dung dịch có dung tích và chất liệu phù hợp.
-
Bước 3: Đổ một lượng nước phù hợp vào bình đựng hóa chất.
-
Bước 4: Thêm từ từ dung dịch axit HCl đặc vào bình chứa nước, đồng thời khuấy nhẹ.
-
Bước 5: Sau khi pha loãng đậy kín bình đựng hóa chất và ghi rõ thông tin, ngày tháng.
Lưu ý: Áp dụng công thức sau để pha chế dung dịch đậm đặc:
Vdd= Cm.M.V.100 : (1000.d.C%)
m= Cm.M.V.100 : (1000.C%)
Trong đó:
-
Vdd (ml): Thể tích dung dịch đậm đặc
-
m (g): Khối lượng cân
-
V (ml): Thể tích dung dịch cần pha
-
D (g/ml): Tỉ trọng
-
C%: Nồng độ phần trăm của dung dịch.

Cách pha loãng axit HCl đặc với nước
4. Công ty sản xuất và cung ứng axit HCl trên toàn quốc
Tại Việt Nam, axit HCl đặc thuộc nhóm hóa chất nguy hiểm, chỉ có một vài địa chỉ uy tín được cấp phép sản xuất và cung cấp ra thị trường dòng sản phẩm này. tự hào là đơn vị đi đầu trong lĩnh vực sản xuất axit HCl với nồng độ 32% – 35%. Ứng dụng trong nhiều lĩnh vực từ sản xuất công nghiệp, xử lý nước và phục vụ nghiên cứu và học tập.

là đơn vị cung cấp axit clo hydric đặc uy tín trên toàn quốc
Khi mua axit HCl tại , quý khách sẽ nhận được:
-
Axit HCl chất lượng, sản xuất tại Việt Nam với mức giá tốt hơn nhiều so với hàng nhập khẩu.
-
Thương hiệu Hóa Chất uy tín, tin cậy và được nhiều khách hàng và đối tác lựa chọn.
-
Hỗ trợ vận chuyển, giao hàng tận nơi đảm bảo an toàn, chuyên nghiệp, đúng tiến độ.
-
Axit HCl được sản xuất số lượng lớn, đáp ứng được các nhu cầu xử lý nước thải và sản xuất công nghiệp trên toàn quốc.
-
Dịch vụ hậu mãi hoàn hảo, nhân viên hỗ trợ giải đáp thắc mắc 24/7.
Nếu quý khách có nhu cầu mua axit HCl đặc hãy liên hệ ngay số HOTLINE để được tư vấn và gửi bảng giá mới nhất hiện nay. cam kết sản phẩm chất lượng, giá tận xưởng cùng với nhiều ưu đãi hấp dẫn cho quý khách khi mua hàng.
