Thời gian làm việc:
Thứ 2 – Thứ 7(07:30 – 17:00)
Mô tả
Axit sulfuric- H2SO4 (12% – 98%)
Nếu bạn còn đang phân vân không biết nên chọn nhà cung cấp nào để mua hóa chất Axit sulfuric- H2SO4 thì đừng nên bỏ qua Công ty XNK Quyết Tâm của chúng tôi. Với nhiều năm kinh nghiệm trong lĩnh vực cung cấp hóa chất, đặc biệt các mặt hàng hóa chất công nghiệp cơ bản của chúng tôi cung cấp có đầy đủ giấy tờ, nguồn góc rõ ràng, đảm bảo chất lượng sẽ đem đến hiệu quả sản xuất cho khách hàng.
Để được tư vấn và báo giá hãy liên hệ ngay với chúng tôi qua thông tin dưới đây:
Thông tin liên hệ:
– Nhà phân phối Công ty TNHH TM DV XNK Quyết Tâm
– Hotline: 0328.492.642 – 0798.279.088
– Email: ctyxnk.quyettam@gmail.com / info@qtchem.vn
– Web: https://qtchem.vn/
- FB: https://facebook.com/xnkquyettam

Axit Sulfuric H2SO4
H2SO4 là gì ?
H2SO4 được gọi tên là axit sunfuric. Axit này ở dạng lỏng không màu, khi quan sát chúng ta có thể thấy chúng sánh lại như dầu. H2SO4 còn có khả năng tan tốt trong nước, từ đó chúng ta có thể pha axit ra bất kỳ tỷ lệ nào theo ý muốn sử dụng của mình.
Giới thiệu về H2SO4
Một số dạng axit H2SO4 thường gặp:
- H2SO4 98%: đây là dạng có nồng độ cao nhất.
- H2SO4 77,67%: nồng độ này thường được chứa ở các tháp axit trong công nghiệp
- H2SO4 62,18%: nồng độ này được sử dụng để sản xuất phân bón.
- H2SO4 33,5%: thường gặp trong các bình acquy
- H2SO4 10%: để sử dụng trên các phòng thí nghiệm.
Quy cách hàng hóa
1. Giao bồn: Từ 5 tấn – 20 tấn
2. Giao tank IBC: từ 1 tấn đến 5 tấn.
3. Giao can nhựa (30 – 35kg)
Cấu tạo của H2SO4
Phân tử H2SO4 được hình thành bởi 2 nguyên tử H, 1 nguyên tử S và 4 nguyên tử O. Tính tổng liên kết của phân tử bao gồm 6 liên kết trong đó bao gồm hai loại liên kết có mặt trong công thức là liên kết cộng hóa trị giữa H – O, O – S và liên kết cho nhận giữa S – O.
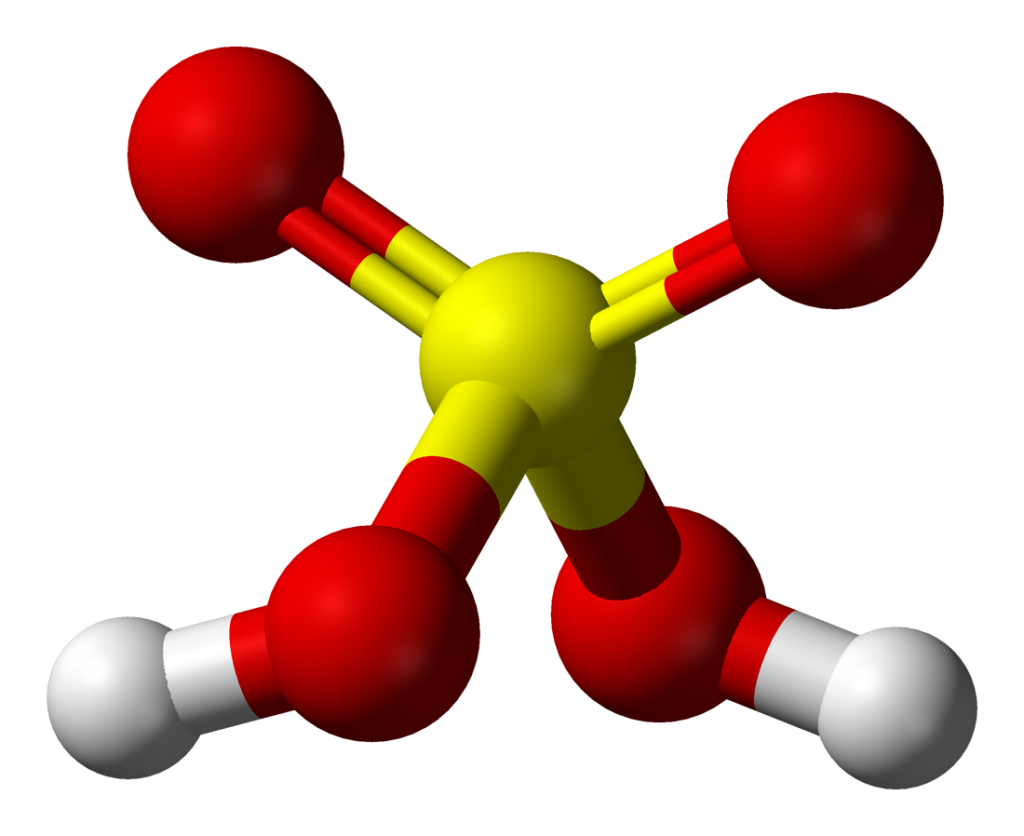
Cấu tạo của H2SO4
Tính chất vật lý của H2SO4
H2SO4 tồn tại ở dạng lỏng, trong suốt với hai dạng là loãng và đặc. Nó có tỷ trọng so với nước là 1,84g/cm3. Nhiệt độ nóng chảy của H2SO4 vào khoảng 10oC. Điểm sôi của axit này là 338oC. Về độ tan thì axit có độ hòa tan tốt, đối với trường hợp H2SO4 đặc khi hòa tan vào nước dẫn tới hiện tượng tỏa nhiệt mạnh do đó cần chú ý trong việc sử dụng axit này.
Tính chất hóa học của H2SO4
Trong số các axit hiện nay thì H2SO4 được sử dụng rộng rãi nhờ vào việc thể hiện đầy đủ các tính chất của một axit điển hình. Hơn thế nữa axit này còn có tính oxi hóa mạnh khi ở dạng đặc. Hãy cùng tìm hiểu kỹ hơn ở các nội dung ngay sau đây.
Dung dịch H2SO4 loãng
Axit sulfuric có khả năng đổi màu quỳ tím sang màu đỏ đặc trưng. Tùy theo nồng độ axit mà màu đỏ cũng sẽ có những sắc độ khác nhau. Axit này tác dụng với những kim loại nằm trước H trong dãy hoạt động hóa học. Quá trình phản ứng sinh ra khí hiđro đặc trưng và muối sunfat:
- Zn + H2SO4 → ZnSO4 + H2

H2SO4 làm đổi màu quỳ tím
H2SO4 cũng sẽ tác dụng với oxit bazơ hoặc bazơ sinh ra sản phẩm là muối và nước. Đặc điểm cuối cùng đó là tác dụng với muối tạo ra muối mới và axit mới. Tuy nhiên điều kiện để phản ứng xảy ra đó chính là tạo được kết tủa hoặc thoát ra khí.
- H2SO4 + Na2O → Na2SO4 + H2O
- H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 + CaCO3 → CaSO4 + CO2 + H2O
Dung dịch H2SO4 đặc
H2SO4 đặc được quan tâm tới bởi vì nó có tính chất hóa học riêng bên cạnh tính axit mạnh của nó. Tính chất riêng ở đây là tính oxi hóa mạnh và tính háo nước mà không phải axit nào cũng có được.
Tính oxi hóa mạnh giúp cho H2SO4 đặc có thể tác dụng với cả những kim loại đứng phía sau Hidro trong dãy hoạt động hóa học. Phản ứng này sinh ra muối và giải phóng khí mùi sốc SO2 cùng với H2O: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
H2SO4 đặc còn tác dụng với phi kim và những chất khử khác nữa. Ví dụ như khi cho H2SO4 đặc tác dụng với Cacbon: C + 2H2SO4 → CO2 + 2H2O + 2SO2 hay khi tác dụng với chất khử như FeO: 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
Tính háo nước là điều cần lưu ý trong quá trình pha loãng loại axit đậm đặc này. Chúng ta cần nắm kỹ cách pha là đổ axit vào nước và tuyệt đối không làm ngược lại để tránh hiện tượng sôi đột ngột gây bắn axit ra bên ngoài.

Chú ý khi pha H2SO4 đặc
Sản xuất H2SO4 trong công nghiệp
Trong công nghiệp thì các nhà máy sản xuất H2SO4 thường đi từ hai nguồn nguyên liệu chính là FeS2 hoặc S. Quá trình diễn ra ba giai đoạn qua các tháp tổng hợp lớn:
- Đầu tiên sẽ đốt nguyên liệu để sản xuất ra lưu huỳnh đioxit.
- Tiếp theo oxi hóa SO2 bằng khí oxi để tạo ra SO3 nhờ xúc tác V2O5.
- Bước cuối cùng thì dùng H2SO4 đặc để hấp thụ SO3 để tạo Oleum, sau đó người ta pha loãng oleum để tạo ra H2SO4.
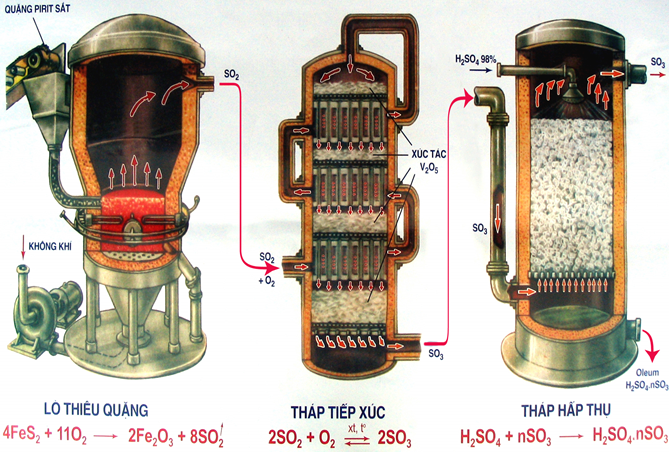
Sản xuất H2SO4
Những ứng dụng nổi bật của H2SO4
Hiện nay các ngành công nghiệp trọng điểm đều cần sử dụng Axit sulfuric như: luyện kim, phân bón, chất tẩy rửa, phẩm nhuộm, chất dẻo, giấy…Trong phòng thí nghiệm thì axit H2SO4 được dùng trong các phản ứng chính của chương trình học giúp cho học sinh làm quen với bộ môn và hiểu rõ hơn tính chất của axit.

Ứng dụng của H2SO4
Lưu ý khi sử dụng axit H2SO4
Như đã nhắc đến ở trên thì Axit sulfuric có tính háo nước do đó khi sử dụng cần cẩn thận tránh việc để axit bắn vào da hay các bộ phận nào trên cơ thể. Kể cả vải cũng sẽ bị cháy nếu tiếp xúc trực tiếp với H2SO4 đặc.
Trong quá trình sử dụng H2SO4 với điều kiện có đun nóng sẽ xuất hiện khí SO2. Nhưng khí này lại độc hại cho nên cần phải chú ý việc thu khí để tránh ảnh hưởng sức khỏe của người sử dụng nó.
Lời kết
Hy vọng những thông tin xoay quanh về Axit sulfuric – H2SO4 sẽ giúp cho bạn biết các tính chất của nó từ đó có cách sử dụng sao cho hợp lý. Hơn thế nữa bạn đọc cũng cần chú ý khi sử dụng axit ở dạng đặc. Hãy thường xuyên theo dõi các bài viết tiếp theo của chúng tôi để biết thêm nhiều kiến thức bổ ích về hóa học hơn nhé.
Để mua hóa chất H2SO4 nồng độ 98%, 50%, 20%,… và hóa chất PAC xử lý nướcthì không nên bỏ qua Hóa Chất XNK Quyết Tâm. Với nhiều năm kinh nghiệm trong ngành hóa chất, quý khách khi mua hàng sẽ nhận được những ưu đãi với giá cả tốt nhất trên thị trường, đội ngũ nhân viên phục tận tình chú đáo, tư vấn miễn phí









Đánh giá
Chưa có đánh giá nào.