Phản ứng oxi hóa khử là gì? Có những loại phản ứng oxi hóa khử gì? Các bước viết phương trình? Phản ứng này được ứng dụng như thế nào? Tất cả các câu hỏi này đều sẽ được giải đáp trong bài viết dưới đây. Hãy cùng tìm hiểu nhé!
Phản ứng oxi hóa khử là gì?
Phản ứng oxi hóa khử là gì?
-
Chất khử: là chất nhường electron, có số oxi hóa tăng lên sau phản ứng. Nó còn được gọi là chất bị oxi hóa.
-
Chất oxi hóa: là chất nhận electron, có số oxi hóa giảm đi sau phản ứng. Nó còn được gọi là chất bị khử.
-
Sự khử (quá trình khử) nghĩa là làm cho một chất nhận electron hay làm giảm số oxi hóa của chất đó.
-
Sự oxi hóa là quá trình oxi hóa một chất, làm cho chất đó nhường electron hay làm tăng số oxi hóa của chất đó.
Như vậy, sự khử và sự oxi hóa là hai quá trình hoàn toàn ngược nhau nhưng chúng xảy ra đồng thời trong cùng một phản ứng oxi hóa-khử. Phản ứng oxi hóa khử là phản ứng hóa học có sự chuyển electron giữa các chất trong phản ứng. Hay có thể hiểu là phản ứng trong đó có sự thay đổi số oxi hóa của một số nguyên tử.
Dấu hiệu nhận biết của phản ứng oxi hóa khử là gì?
Dựa vào định nghĩa phản ứng oxi hóa khử là gì phía trên, ta có thể dễ dàng thấy dấu hiệu nhận biết phản ứng oxi hóa khử là gì. Theo đó, dấu hiệu nhận biết ở đây là sự thay đổi tăng giảm số oxi hóa của một nguyên tố.
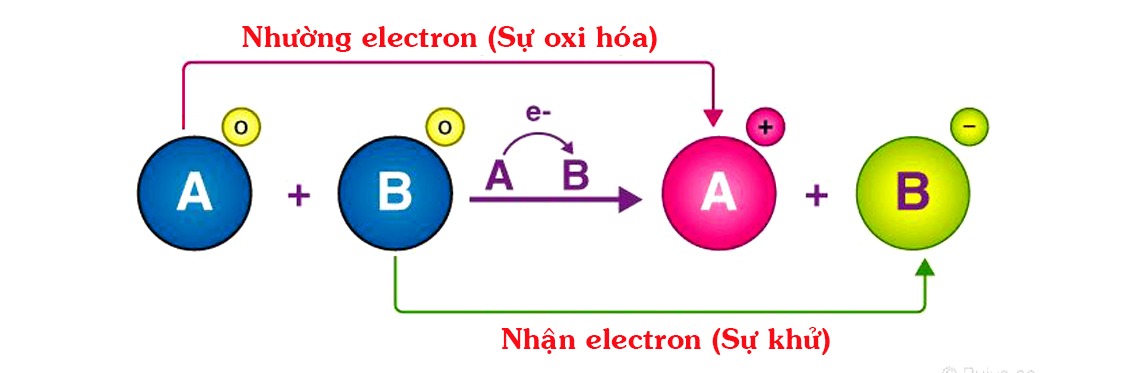
Dấu hiệu nhận biết của phản ứng oxi hóa khử là gì?
Ta có thể nhận biết dễ dàng các phản ứng oxi hóa khử trong đời sống như quá trình hô hấp của thực vật. Chúng hấp thụ khí cacbonic, giải phóng oxi và nhiều quá trình trao đổi khác. Hay nó có thể là sự đốt cháy nhiên liệu, các quá trình điện phân, các phản ứng xảy ra trong pin, chúng đều là quá trình oxi hóa khử. Ngoài ra, các quá trình sản xuất luyện kim, chất dẻo, dược phẩm, phân bón hóa học,… cũng đều là biểu hiện của sự oxi hóa – khử.
Các loại phản ứng oxi hóa khử
Phản ứng oxi hóa khử có nhiều dạng khác nhau như dạng thông thường, phản ứng nội phân tử, oxi hóa khử tự nhiên hay phản ứng oxi hóa khử phức tạp.
-
Phản ứng oxi hóa khử dạng thông thường: Đây là phản ứng hóa học mà trong đó có một chất oxi hóa và một chất khử rõ ràng. Ví dụ:
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O
-
Phản ứng nội phân tử: Là phản ứng oxi hóa khử chỉ xảy ra trong một phân tử. Ví dụ:
AgNO3 → Ag + NO2 + O2
Cu(NO3)2 → CuO + NO2 + O2
-
Phản ứng oxi hóa khử tự nhiên: Là phản ứng oxi hóa khử trong đó sự tăng giảm số oxi hóa xảy ra chỉ trên 1 nguyên tố. Ví dụ:
Cl2 + 2KOH → KCl + KClO + H2O
4KClO3 → 3KClO4 + KCl
-
Phản ứng oxi hóa khử phức tạp: là những phản ứng hóa học có sự thay đổi số oxi hóa của nhiều hơn 2 nguyên tử. Ví dụ:
Cu2S + HNO3 → Cu(NO3)2 + CuSO4 + NO + H2O
Các bước viết phương trình của phản ứng oxi hóa khử
Từ định nghĩa phản ứng oxi hóa – khử, chất khử nhường hẳn electron cho chất oxi hóa, ta có thể cân bằng phương trình hóa học của phản ứng theo phương pháp cân bằng electron. Đây là phương pháp cân bằng dựa trên nguyên tắc: Tổng số electron của chất khử nhường và chất oxi hóa nhận phải bằng nhau.
Lập phương trình hóa học của phản ứng oxi hóa khử với 4 bước:
-
Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để biết chất nào là chất oxi hóa và chất nào là chất khử.
-
Bước 2: Viết phương trình oxi hóa và quá trình khử sau đó cân bằng phương trình phản ứng.
-
Bước 3: Tìm hệ số thích hợp của chất oxi hóa và chất khử sao cho tổng số electron của chất khử nhường và chất oxi hóa nhận bằng nhau.
-
Bước 4: Ghi các hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Tiếp đó, cân bằng số nguyên tử của các nguyên tố để hoàn thành lập phương trình hóa học.
Ứng dụng phản ứng oxi hóa khử trong đời sống
Phản ứng oxi hóa khử là phản ứng hóa học quan trọng và phổ biến trong tự nhiên, được ứng dụng trong nhiều hoạt động sản xuất và đời sống. Nó được sử dụng hợp lý để tăng hiệu suất sản phẩm cũng như nâng cao chất lượng của chúng.
Một số ứng dụng phổ biến của phản ứng oxi hóa khử là:
-
Trong công nghiệp: Áp dụng phản ứng oxi hóa khử để thiết lập nhiều khâu trong dây chuyền công nghệ. Ví dụ như luyện nhôm, gang thép, sản xuất phân bón, thuốc bảo vệ thực vật, dược phẩm, …

Ứng dụng phản ứng oxi hóa khử trong luyện nhôm
-
Trong đời sống hàng ngày: Phần lớn các loại năng lượng con người đang sử dụng là năng lượng từ những phản ứng oxi hóa khử. Ví dụ như sự cháy của than củi, tiêu đốt xăng dầu trong các động cơ trong, các phản ứng xảy ra trong pin, ắc quy…
Thực tế, còn rất nhiều phản ứng oxi hóa khử diễn ra tự nhiên như trong quá trình kim loại bị ăn mòn. Tuy nhiên, các nhà nghiên cứu cũng đã có những biện pháp nhằm hạn chế các phản ứng oxi hóa khử không có lợi này.
Bài tập ví dụ về phản ứng oxi hóa khử
Chọn đáp án đúng nhất
Câu 1. Xác định hệ số cân bằng của MnSO4 trong phản ứng sau:
KMnO4 +SO2 + H2O → MnSO4 + K2SO4 + H2SO4
A. 2
B. 5
C. 7
D. 10
⇒ Đáp án A
Câu 2. Trong các chất : FeCl2, FeCl3, FeSO4, Fe2(SO4)3, Fe(NO3)2, Fe(NO3)3. Có bao nhiêu chất có cả tính oxi hoá và tính khử
A. 2
B. 3
C. 5
D. 4
⇒ Đáp án B
Câu 3. Hòa tan hoàn toàn 20g hỗn hợp Fe và Mg vào dung dịch axit HCl dư, ta thấy 11,2 lít khí thoát ra ở đktc và dung dịch X. Cô cạn dung dịch X, sau phản ứng thu được bao nhiêu gam muối khan?
A. 55,5g
B. 91,0g
C. 90,0g
D. 71,0g
⇒ Đáp án A
Câu 4. Hòa tan 15 gam hỗn hợp X gồm hai kim loại Al và Mg vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí NO, NO2, N2O, SO2. Phần trăm khối lượng của Al và Mg trong hỗn hợp X lần lượt là:
A. 63% và 37%
B. 36% và 64%
C. 50% và 50%
D. 46% và 54%
⇒ Đáp án B
Câu 5. Trong các chất sau, chất nào luôn là chất oxi hóa khi tham gia các phản ứng oxi hóa – khử : Fe2O3, I2, O2, FeCl2, HNO3, H2S, SO2?
A. KMnO4, I2, HNO3
B. O2, Fe2O3, HNO3
C. HNO3, H2S, SO2
D. FeCl2, I2, HNO3
⇒ Đáp án B
Hy vọng với những chia sẻ về phản ứng oxi hóa khử là gì? cùng một số bài tập trên đây, các bạn học sinh đã có thể vận dụng làm bài tập hiệu quả nhất. Truy cập Website fđể tìm hiểu thêm các kiến thức về hóa học!