Axit pecloric không chỉ là hợp chất khoáng đóng vai trò quan trọng trong công nghiệp sản xuất mà chúng còn được ứng dụng rộng rãi trong đời sống hàng ngày. Với bài viết này, sẽ cùng bạn đọc đi tìm hiểu về Axit pecloric cũng như những ứng dụng quan trọng của chúng đối với cuộc sống con người.
Những kiến thức cân biết về axit pecloric
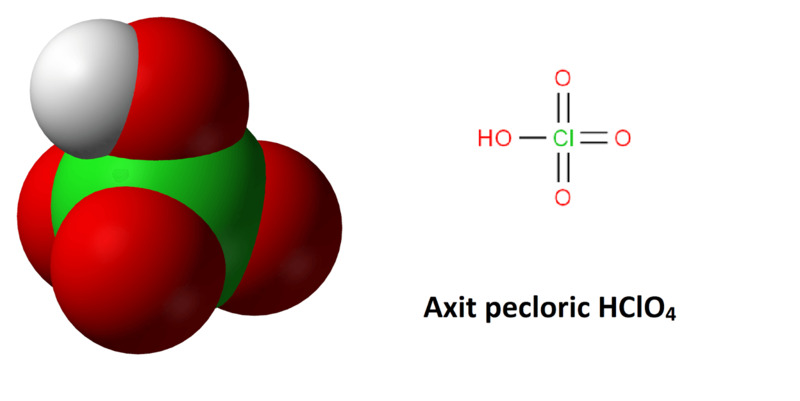
1. Axit pecloric là gì?
Axit pecloric là một hợp chất vô cơ, tồn tại dưới dạng chất lỏng , không màu. Hợp chất này là một axit mạnh hơn cả axit nitric và axit sulfuric, với công thức hóa học là HClO4. Bên cạnh đó, axit pecloric còn là chất oxi hóa mạnh, rất dễ tan trong nước và dễ gây ra cháy nổ.
Chúng thường sẽ bị phân hủy dưới áp suất thường, khi đun nóng đến 100 độ C thì hợp chất này sẽ hóa lỏng, chuyển màu đỏ nâu và gây ra cháy nổ, do HClO4 khan kém bền.
Ngoài ra, axit pecloric đóng vai trò cực kỳ quan trọng trong quá trình phân tích khoáng chất hoặc sử dụng như một chất xúc tác và dùng trong phân hủy các quặng phức tạp.
2. Tính chất lý hóa nổi bật của axit pecloric
Mỗi hợp chất đều sở hữu những tính chất vật lý và hóa học đặc trưng riêng, axit pecloric cũng vậy. Sau khi tìm hiểu về định nghĩa của axit pecloric, chúng ta hãy cùng xem xét về những tính chất nổi bật của loại axit này nhé.
2.1.Tính chất vật lý
Với những tính chất vật lý nổi bật, axit pecloric tồn tại ở dạng chất lỏng, không màu, có khối lượng mol là 100,46 g/mol, khối lượng riêng là 1,67 g/cm3. Với điểm nóng chảy khi ở dạng khan là -112 độ C, dạng hỗn hợp đẳng phí là -17 độ C.
Bên cạnh đó, hợp chất này còn có điểm sôi là 203 độ C khi ở hỗn hợp đẳng phí.
2.2.Tính chất hóa học
-
Tham gia vào phản ứng oxi hóa khử: khi nhiệt phân HClO4 với chất xúc tác cùng nhiệt độ P2O5, ta thu được Cl2O7 có bọt khí sủi lên.
2HClO4 → H2O + Cl2O7
-
Ngoài ra, HClO4 còn xảy ra phản ứng với một số chất khác như:
HClO4 + NH2OH → (NH3OH)ClO4
PH3 +HClO4→ PH4ClO4
KOH + HClO4 → H2O + KClO
HClO4 + HF → H2O + ClO3F
NaOH + HClO4 → H2O + NaClO4
P2O5 + 6HClO4 → 3Cl2O7 + 2H3PO4
2F2 + 4HClO4 → 2H2O + O2 + 4ClO3F
Cs2CO3 + 2HClO4 → H2O + CO2 + 2CsClO4
-
Một số lưu ý khác:
Về tính axit của axit pecloric, chúng thường được xét trong môi trường dung môi là nước. Đồng thời, loại axit này sẽ phụ thuộc vào độ bền của liên kết H-O (khả năng phân ly H+) và được biểu thị qua chỉ số pKa (hằng số phân ly axit)
HClO < HClO2 < HClO3 < HClO4
Về tính oxi hóa: HClO > HClO2 > HClO3 > HClO4
3. Phương pháp điều chế axit pecloric hiệu quả
Thông thường, axit pecloric được điều chế theo 2 phương pháp đó là điều chế trong phòng thí nghiệm và trong công nghiệp.

Phương pháp điều chế HClO4 hiệu quả
3.1.Trong phòng thí nghiệm
Cho bari peclorat phản ứng với axit sunfuric, sản phẩm tạo ra là axit pecloric và bari sunfat kết tủa.
Ba(ClO4)2 + H2SO4 → BaSO4 + 2HClO4
Không chỉ vậy, hợp chất này còn có thể điều chế bằng cách cho amoni peclorat và axit nitric tác dụng với nhau.
3.2. Điều chế trong công nghiệp
Để điều chế trong công nghiệp, ta có thể áp dụng theo hai cách.
Cách 1: Cho natri peclorat phản ứng với axit clohydric:
NaClO4 + HCl → NaCl (kết tủa) + HClO4
Cách 2: Bằng cách chưng cất tinh chế ra axit đặc. Trực tiếp hơn và không cần sử dụng chất phản ứng là muối để tạo ra oxi hóa anot của dung dịch nước clo ở điện cực bạch kim.
4. Vai trò của axit pecloric quan trọng như thế nào?
Axit pecloric không chỉ là nguyên liệu quan trọng trong công nghiệp, chúng còn được ứng dụng rộng rãi trong hóa học.
4.1. Trong công nghiệp

Nguyên liệu quan trọng trong sản xuất tên lửa
-
Axit pecloric được ứng dụng trong quá trình điều chế các muối peclorat, đặc biệt là amoni peclorat. Đây được coi là một trong những nguyên liệu quan trọng trong sản xuất tên lửa. Ngành công nghiệp tên lửa đã phát triển mạnh mẽ với lượng axit pecloric được sản xuất hàng triệu tấn mỗi năm.
-
Bên cạnh đó, hợp chất này còn tham gia vào quá trình sản xuất pin, đặc biệt là pin có elektro cơ bản là kẽm và magie.
-
Trong ngành công nghiệp sản xuất linh kiện điện tử, axit pecloric cũng được dùng để tạo điều kiện làm sạch và etsing trên bề mặt của các vật liệu như kim loại.
-
Không chỉ vậy, axit này còn được sử dụng với vai trò như một chất xúc tác trong quá trình sản xuất dược phẩm và tổng hợp hóa học.
4.2. Trong hóa học
-
HClO4 được sử dụng rộng rãi trong chạm, khắc lên bề mặt molypden, nhôm và một vài kim loại khác.
-
Do có tính axit mạnh và là một trong những axit mạnh nhất, axit pecloric được dùng trong nhiều sự tổng hợp.
-
Hơn nữa, chúng còn đóng vai trò là dung môi hữu ích trong các phản ứng trao đổi ion.
-
Ngoài ra, axit pecloric cũng được ứng dụng trong các phòng thí nghiệm và cơ quan sản xuất các sản phẩm hóa chất và dùng để phân tích hóa học và kiểm nghiệm chất lượng.

Ứng dụng phổ biến trong phòng thí nghiệm
5. Nồng độ axit pecloric an toàn khi tiếp xúc
Để đảm bảo an toàn cho con người khi tiếp xúc với hóa chất, thường phụ thuộc vào nhiều yếu tố như điều kiện làm việc, thời gian tiếp xúc, loại tiếp xúc như da, mắt,…
Khi axit pecloric ở nồng độ thấp, chúng được sử dụng một cách an toàn trong nhiều ứng dụng nghiên cứu và công nghệ. Thế nhưng, việc thiết lập giới hạn an toàn cụ thể thường phụ thuộc vào tiêu chuẩn an toàn và quy định của tổ chức hoặc quốc gia.
Chính vì vậy, người lao động và người quản lý an toàn cần tuân thủ mọi quy tắc an toàn, cũng như hướng dẫn được đưa ra.
6. Những lưu ý cần biết khi sử dụng và bảo quản axit pecloric
Bất cứ khi nào sử dụng hóa chất, bạn cần trang bị đầy đủ những kiến thức liên quan đến việc sử dụng và bảo quản, cũng như biện pháp xử lý khi tiếp xúc.
6.1. Những cảnh báo nguy hiểm
-
H271: có khả năng gây cháy hoặc nổ, chất oxy hóa mạnh
-
H290: có thể ăn mòn kim loại
-
H302: nếu nuốt phải sẽ có hại cho sức khỏe
-
H314: có khả năng gây tổn thương mắt và gây bỏng da nặng
-
H373: trong trường hợp tình trạng phơi nhiễm lặp đi lặp lại hoặc kéo dài có thể gây nên các tổn thương cơ quan (tuyến giáp).
6.2. Lưu ý khi sử dụng và bảo quản
-
Nên đặt axit pecloric ở những khu vực tránh xa các nguồn nhiệt, lửa.
-
Không trộn lẫn kiếm với các chất dễ cháy hay axit. hợp chất kim loại nặng.
-
Khi tiếp xúc hóa chất, bạn cần trang bị các đồ bảo hộ chuyên dụng như quần áo bảo hộ, găng tay, kính mắt,…
-
Đối với các hợp chất hữu cơ như gỗ, quần áo,… khi tiếp xúc với axit pecloric đậm đặc sẽ có thể bốc cháy. Chính vì vậy, khi bảo quản và sử dụng cần hết sức thận trọng.
6.3.Biện pháp xử lý sự cố
-
Tác động đối với da và mắt:
Nếu hóa chất tiếp xúc với mắt, cần tháo kính áp tròng nếu có, rửa sạch với nước. Bởi axit pecloric có thể gây kích ứng và tổn thương. Nó có thể làm khô, đỏ, và gây đau rát cho da. Nếu tiếp xúc trực tiếp với mắt, perchloric acid có thể gây nghiêm trọng và kéo dài.
-
Đối với đường hô hấp:
Trong trường hợp hít phải hóa chất này, nạn nhân có thể bị kích thích đường hô hấp và xuất hiện những triệu chứng như khó chịu, đau họng và khó khăn khi thở.
-
Đối với hệ tiêu hóa:
Khi nuốt phải axit pecloric có thể gây kích thích đường tiêu hóa, xuất hiện những triệu chứng như đau bụng, buồn nôn hoặc dẫn đến những vấn đề nghiêm trọng hơn. Vì vậy, bạn cần súc miệng và đặc biệt không được gây nôn.
-
Hãy gọi ngay đến trung tâm chống độc nếu bị phơi nhiễm hay xảy ra điều gì bất thường hoặc cần bác sĩ tư vấn.
Hiện nay, ngày càng nhiều các đơn vị cung cấp và sản xuất hóa chất này trên thị trường. Tuy nhiên, để phân biệt được sản phẩm chất lượng, đơn vị cung cấp uy tín lại là một sự khó khăn lớn đối với người tiêu dùng. Chính vì vậy, bạn cần xem xét thật kỹ lưỡng, tham khảo nhiều nơi trước khi đưa ra quyết định.
Tóm lại, với những tính chất đặc trưng, axit pecloric là nguyên liệu quan trọng tham gia vào công nghiệp sản xuất và trong phòng thí nghiệm. Hi vọng, với những thông tin mà cung cấp sẽ giúp bạn đọc hiểu hơn về loại axit này.
